Раскрыли причину медлительности эволюции белков
Некоторые ученые думают, что эволюция белков сдерживается низкой проходимостью ландшафта приспособленности.
«Рецепторный белок PhoQ передает сигнал из внешней среды внутрь клетки, взаимодействуя с белком PhoP. Ключевую роль в работе PhoQ играют четыре аминокислотные позиции, образующие «белок-белковый интерфейс» и позволяющие безошибочно распознавать PhoP. Американские биологи экспериментально изучили свойства всех возможных аминокислотных комбинаций, занимающих эти ключевые позиции. Неожиданно оказалось, что из 160 000 комбинаций целых 1659 (более 1%) успешно справляются с функцией распознавания PhoP. Это означает, что «белковый код», обеспечивающий узнавание белками друг друга, обладает высокой избыточностью, подобно генетическому коду. При этом эволюционные маршруты от одних «разрешенных» последовательностей к другим, как правило, оказываются длинными и окольными. Это объясняется сильным эпистазом — зависимостью полезности мутации от того, какие мутации успели закрепиться ранее. Возможно, из-за эпистаза эволюция не успевает найти многие потенциально удачные решения, а ее пути становятся до некоторой степени предсказуемыми.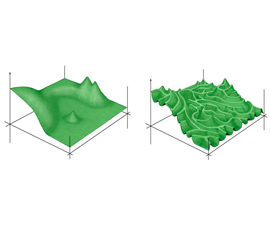 Чтобы понять, как эволюционируют белки, очень важно расшифровать структуру ландшафта приспособленности конкретных белков. Конечно, лучше всего было бы провести полное картирование пространства последовательностей, определив для каждой его точки эффективность выполнения белком интересующей нас функции. Однако такая задача невыполнима, поскольку даже для маленькой белковой молекулы длиной в 100 аминокислот число точек в пространстве последовательностей (то есть число всех возможных аминокислотных последовательностей такой длины) на много порядков превышает число атомов во Вселенной (первое равно 20100 ≈ 10130, второе — в 1050 раз меньше).
Чтобы понять, как эволюционируют белки, очень важно расшифровать структуру ландшафта приспособленности конкретных белков. Конечно, лучше всего было бы провести полное картирование пространства последовательностей, определив для каждой его точки эффективность выполнения белком интересующей нас функции. Однако такая задача невыполнима, поскольку даже для маленькой белковой молекулы длиной в 100 аминокислот число точек в пространстве последовательностей (то есть число всех возможных аминокислотных последовательностей такой длины) на много порядков превышает число атомов во Вселенной (первое равно 20100 ≈ 10130, второе — в 1050 раз меньше).
Поэтому ученым приходится ограничиваться картированием очень маленьких, специально отобранных участков пространства последовательностей.
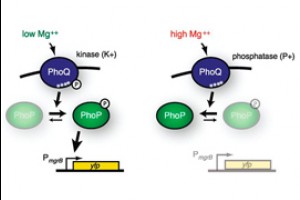
Сегодня, благодаря стремительному развитию биотехнологий, появилась возможность картировать намного более обширные области. Об этом свидетельствует статья Анны Подгорной (Anna I. Podgornaia) и Майкла Лауба (Michael T. Laub) из Массачусетского технологического института, опубликованная в свежем выпуске журнала Science. Авторы сосредоточили усилия на четырех ключевых аминокислотах, входящих в состав белка PhoQ кишечной палочки Escherichia coli. Белки, гомологичные PhoQ, есть и у других гамма-протеобактерий, таких как сальмонелла и чумная палочка. PhoQ — это рецептор, располагающийся на внутренней мембране бактерии. PhoQ реагирует на изменения концентрации ионов Mg2+ в периплазматическом пространстве и передает сигнал в цитоплазму посредством активации или инактивации белка PhoP (см. PhoP-PhoQ). Белок PhoP, в свою очередь, включает и выключает гены, необходимые для адаптации бактерии к меняющимся условиям среды.
Ключевую роль в работе двухкомпонентной регуляторной системы PhoQ-PhoP играют четыре аминокислоты, входящие в состав PhoQ и образующие так называемый белок-белковый интерфейс. Эти аминокислоты необходимы для того, чтобы PhoQ мог безошибочно опознать своего партнера PhoP и правильно провзаимодействовать с ним.
В белке PhoQ кишечной палочки эти четыре позиции заняты следующими аминокислотами: аланин в позиции 284, валин в позиции 285, серин в позиции 288, треонин в позиции 289 (сокращенно Ala284, Val285, Ser288, Thr289, или еще короче — AVST).
Но AVST — лишь одна из 160 000 (204) возможных комбинаций четырех аминокислот. Авторы поставили перед собой амбициозную задачу: картировать всё пространство последовательностей для данных четырех аминокислотных позиций. То есть для каждой из 160 000 комбинаций проверить, обеспечивает ли она нормальное взаимодействие PhoQ с PhoP, а значит, и правильную работу всей регуляторной системы.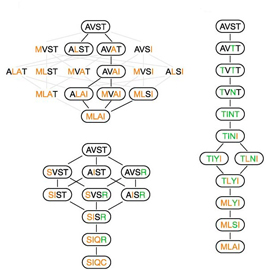 Для этого были изготовлены плазмиды с геном phoQ, в котором триплеты нуклеотидов, кодирующие аминокислоты белок-белкового интерфейса AVST, были полностью рандомизированы, то есть заменены на случайные тройки нуклеотидов. Авторы использовали метод сайт-направленного мутагенеза с помощью ПЦР (см.: Site-directed mutagenesis). Затем эти плазмиды вставили в клетки E. coli, из которых их собственный ген phoQ был заблаговременно удален. Кроме того, в геном подопытного штамма вставили ген желтого флуоресцирующего белка под управлением промотора, контролируемого белком PhoP. В итоге получилась разношерстная популяция кишечных палочек, у которых в гене phoQ на месте четырех триплетов, кодирующих аминокислоты AVST, находились все возможные триплеты, кодирующие все 160 000 возможных аминокислотных комбинаций (комбинаций на самом деле получилось больше, потому что есть ведь еще и стоп-кодоны, но те бактерии, которым так не повезло, не были предметом дальнейшего изучения).
Для этого были изготовлены плазмиды с геном phoQ, в котором триплеты нуклеотидов, кодирующие аминокислоты белок-белкового интерфейса AVST, были полностью рандомизированы, то есть заменены на случайные тройки нуклеотидов. Авторы использовали метод сайт-направленного мутагенеза с помощью ПЦР (см.: Site-directed mutagenesis). Затем эти плазмиды вставили в клетки E. coli, из которых их собственный ген phoQ был заблаговременно удален. Кроме того, в геном подопытного штамма вставили ген желтого флуоресцирующего белка под управлением промотора, контролируемого белком PhoP. В итоге получилась разношерстная популяция кишечных палочек, у которых в гене phoQ на месте четырех триплетов, кодирующих аминокислоты AVST, находились все возможные триплеты, кодирующие все 160 000 возможных аминокислотных комбинаций (комбинаций на самом деле получилось больше, потому что есть ведь еще и стоп-кодоны, но те бактерии, которым так не повезло, не были предметом дальнейшего изучения).
Теперь нужно было выбрать из этой популяции те клетки, у которых система PhoQ-PhoP по-прежнему исправно работала. Отбор проводился в два этапа. Сначала микробов выращивали при разных концентрациях магния и отбирали микробов, у которых сила желтого свечения соответствовала таковой у контрольных бактерий с последовательностью AVST. Затем отобранных микробов помещали в среду, не содержащую магния. Выдержать такое «магниевое голодание» способны только бактерии с исправно работающей системой PhoQ-PhoP.
Бактерий, выдержавших эти испытания, подвергли секвенированию, чтобы получить полный список аминокислотных последовательностей, обеспечивающих нормальную работу PhoQ-PhoP. Таких последовательностей, позволяющих белку PhoQ нормально взаимодействовать с PhoP, оказалось неожиданно много: целых 1659. Авторы выборочно проверили некоторые из мутантных штаммов на способность конкурировать с контрольными кишечными палочками при разных концентрациях магния. Эти эксперименты показали, что приспособленность мутантов осталась на том же уровне, что и у исходного штамма. Таким образом, по крайней мере некоторые (а скорее всего, большинство) из выявленных 1659 последовательностей не имеют каких-либо серьезных дефектов по сравнению с исходной последовательностью AVST.
Это один из главных результатов обсуждаемой работы. Он показывает, что «плато» ландшафта приспособленности, соответствующее функциональному белок-белковому интерфейсу, весьма обширно: оно занимает более одного процента всего пространства последовательностей (1659 точек из 160 000). Это значит, что, подобно генетическому коду, в котором 20 аминокислот и знак «стоп» кодируются 64 триплетами, «белок-белковый» код, обеспечивающий узнавание белками друг друга, тоже обладает высокой избыточностью («вырожденностью»). Это, по идее, должно облегчать функциональную эволюцию белков. Чем обширнее плато ландшафта приспособленности, соответствующее данной функции, тем больше шансов, что с какой-нибудь его точки удастся перейти (или перепрыгнуть) на другое. Иными словами, повышается вероятность смены функции белка в ходе эволюции.Полученные данные позволили авторам детально изучить топографию плато и оценить его «эволюционную проходимость». Принципиальный вопрос, от ответа на который зависит общая динамика нейтральных (не полезных и не вредных, сохраняющих функцию белка) эволюционных изменений, то есть динамика перемещения эволюционирующей молекулы по плато ландшафта приспособленности, состоит в том, насколько сильным является влияние четырех аминокислотных позиций друг на друга. Генетики называют такое влияние «эпистазом». Если эпистаз отсутствует, то плато представляет собой ровную плоскую поверхность, по которой эволюционирующий белок может гулять абсолютно свободно. Есть некий набор «разрешенных» аминокислотных замен, и приобретать их можно в любом порядке. При сильном эпистазе плато становится похоже на лабиринт узких тропинок, разделенных пропастями. По такому плато передвигаться трудно, потому что аминокислотные замены, безвредные в одних контекстах, оказываются вредными в других. В результате порядок приобретения замен становится крайне важным: к каждой точке пространства последовательностей можно теперь добраться лишь строго определенными немногочисленными маршрутами. Следовательно, можно ожидать, что многие работоспособные последовательности до сих пор не найдены эволюцией просто потому, что у нее не хватило на это времени.
Анализ полученного списка из 1659 работоспособных последовательностей показал сильнейшее взаимное влияние четырех аминокислотных позиций, то есть очень сильный эпистаз. Это второй главный результат исследования. В наличии эпистаза можно убедиться разными способами. Например, можно сравнить друг с другом последовательности, отличающиеся от AVST одной, двумя, тремя и четырьмя аминокислотами. Авторы обнаружили среди функциональных («разрешенных») последовательностей 16 одиночных мутантов, 100 двойных, 544 тройных и 998 четверных, то есть таких, в которых все четыре аминокислоты отличаются от исходных A, V, S и T. Если бы эпистаза не было, то разрешенные множественные мутации представляли бы собой просто-напросто произвольные комбинации одиночных. Однако ничего подобного не наблюдается. Каждая отдельная аминокислотная замена оказывается разрешенной в одних сочетаниях и запрещенной в других. Из-за этого кратчайший разрешенный эволюционный путь от одной последовательности к другой в большинстве случаев оказывается длиннее, чем кратчайший из потенциально возможных.
Рассмотрим, например, переход от AVST к разрешенной последовательности MLAI. Чтобы превратить AVST в MLAI, нужно заменить четыре аминокислоты. Соответственно, если считать аминокислотную замену единичным эволюционным событием, то кратчайший потенциально возможный путь от AVST к MLAI будет состоять из четырех шагов. Разных путей такой длины потенциально существует 24, поскольку аминокислоты можно заменять в разном порядке. Однако из этих 24 путей разрешенными являются только два. Все остальные пути требуют пересечения «пропасти» на ландшафте приспособленности, то есть прохождения через нефункциональный промежуточный этап.
Во многих случаях все кратчайшие пути оказываются запрещенными. Тогда маршрут из одной точки пространства последовательностей в другую (например, путь от AVST к SIQC, показанный на рис. 3 слева внизу) оказывается длиннее, чем кратчайший из потенциально возможных.
Ну а если учесть, что реальные единичные мутации обычно представляют собой замену одного нуклеотида в ДНК (а не триплета на любой другой триплет), то проходимость ландшафта окажется еще ниже. Теперь он состоит не из четырех, а из целых десяти шагов. Это объясняется структурой генетического кода, которая позволяет путем единичных нуклеотидных замен переходить от данной аминокислоты только к некоторым, но не к любым другим аминокислотам. Например, фенилаланин кодируется триплетами UUU и UUC. Изменив в любом из этих триплетов только одну букву, можно заменить в белковой молекуле фенилаланин на лейцин, изолейцин, валин, серин, тирозин или цистеин. Для перехода к любой из оставшихся 13 аминокислот потребуется не одна, а две или три нуклеотидных замены. Таким образом, эпистаз и структура генетического кода совместными усилиями делают ландшафт приспособленности труднопроходимым.
Плато мало похоже на гладкое, легко проходимое поле. Оно подразделяется на несколько областей, внутри каждой из которых эволюционирующий белок может передвигаться относительно свободно, однако переход в соседнюю область возможен лишь по немногочисленным тропкам. Особенно хорошо это видно на нижнем рисунке, где ребра графа соответствуют нуклеотидным, а не аминокислотным заменам. Некоторые разрешенные последовательности вообще оказались недосягаемыми из «обжитой» области пространства последовательностей (изолированные кружочки на нижнем рисунке, к которым не подходит ни одна линия).
Авторы также проанализировали те варианты последовательностей из числа найденных ими 1659, которые реально встречаются у родственников кишечной палочки — других гамма-протеобактерий. Характерно, что все красные кружки расположены в той же самой «обжитой» области пространства последовательностей, что и AVST. Возможно, это означает, что нейтральная эволюция белок-белкового интерфейса действительно была настолько затруднена эпистазом и структурой генетического кода, что эволюция просто не успела «разведать» многие потенциально доступные области пространства последовательностей.
Данное исследование кому-то может показаться слишком скучным и специальным. Но только не биологам, привыкшим считать «пространство последовательностей» и «ландшафт приспособленности» абстракциями, полезными для теоретических построений, но практически недосягаемыми для реального изучения. Больше всего впечатляет сам факт, что стало возможным прямое экспериментальное картирование довольно обширных областей пространства последовательностей. Подобные пионерские исследования открывают путь к пониманию фундаментальных законов эволюции белков и к построению более точных эволюционных моделей. Хотя, конечно, речь пока идет лишь о четырех аминокислотных позициях, то есть о переборе 204 вариантов. Полное картирование пространства всех возможных белков навсегда останется неразрешимой задачей,- говорится в статье на сайте «Элементов».